Visualmente limpo: trazendo clareza às diretrizes regulatórias
Por Thomas Altmann, Gestor Técnico de CIPCOP Global, Validação de Limpeza

"Visualmente limpo" é um termo usado em quase todas as regulamentações farmacêuticas (FDA, PIC/S, GMP). Em termos simples, o equipamento usado na produção farmacêutica deve ser inspecionado quanto à limpeza visual antes do uso1.
Faz todo o sentido — mas poucos são 100% claros sobre o que uma limpeza visual significa em procedimentos operacionais padrão e como documentá-la para validação da limpeza. As perguntas mais comuns incluem:
- Como são os resíduos?
- Qual é o limite visual?
- Como o material de construção afeta a visibilidade?
- Com que frequência a visão de um inspetor precisa ser examinada?
Veja abaixo uma breve discussão sobre cada uma dessas questões.
Como são os resíduos?
Seus inspetores precisam saber o que estão procurando ao inspecionar o equipamento. Eles deveriam, na melhor das hipóteses, saber diferenciar os resíduos de processos dos resíduos deixados por detergentes e produtos de sanitização — e como se apresentariam os baixos níveis de cada tipo de resíduo. Além disso, os inspetores devem conhecer a aparência da superfície visualmente limpa, incluindo a coloração de aços, arranhões ou outros danos que não influenciam a etapa seguinte de produção.
Por exemplo, Ingredientes Farmacêuticos Ativos (API) frequentemente se aparecem como pós e resíduos de detergente podem ser observados como manchas na superfície.

Os resíduos de API frequentemente aparecem como pós.

Os resíduos de detergente geralmente aparecem como manchas.
Os resíduos de detergente frequentemente não são percebidos pelos inspetores de "limpeza visual". Os produtores da indústria farmacêutica que usam detergentes projetados para aplicações de alimentos e bebidas devem estar cientes de que resíduos de ingredientes não solúveis em água, como inibidores de corrosão ou surfactantes específicos, podem permanecer e criar uma interação inesperada com resíduos de APIs e podem ser transportados para o produto fabricado subsequente.
Como o material de construção afeta a aparência?
Os resíduos podem ter diferentes aparências dependendo do material usado para construir o equipamento que está sendo inspecionado. Aproximadamente 90% do equipamento usado na produção farmacêutica é feito de aço inoxidável — com vidro, borracha e polímeros como Teflon e EPDM respondendo pela maior parte do restante.
Ao selecionar os inspetores de treinamento e equipamento, deve-se levar em conta que detectar resíduos em superfícies de polímero será mais difícil do que detectar resíduos em equipamentos feitos de aço inoxidável.
Dito isso, equipamentos de aço inoxidável expostos a temperaturas elevadas podem/irão descolorir com o tempo, dificultando a identificação de resíduos em comparação com quando o equipamento foi entregue. Quaisquer superfícies do equipamento que fiquem arranhadas terão que ser polidas novamente (se possível) ou substituídas, pois a limpeza visual não pode mais ser verificada com segurança.

Os inspetores devem ser treinados para identificar como cada tipo de resíduo se apresenta em cada tipo de superfície.

A aparência dos resíduos pode ser afetada por diferentes acabamentos do material (aço inoxidável em comparação com Teflon ou aço inoxidável novo/polido em comparação com sua versão descolorida).
Qual é o limite visual?
O limite visual é o nível de concentração quando um API ou resíduo se torna visível. Os fabricantes precisam determinar o limite visual para cada API ou resíduo — e então compará-lo ao nível em que esse API ou resíduo se torna toxicologicamente relevante. Se o limite visual for inferior ao nível toxicologicamente relevante predeterminado para aquele API ou resíduo de limpeza, a limpeza visual é uma medida válida.
A análise abaixo mostra a concentração em que o paracetamol (um API de risco relativamente baixo) se torna visível.
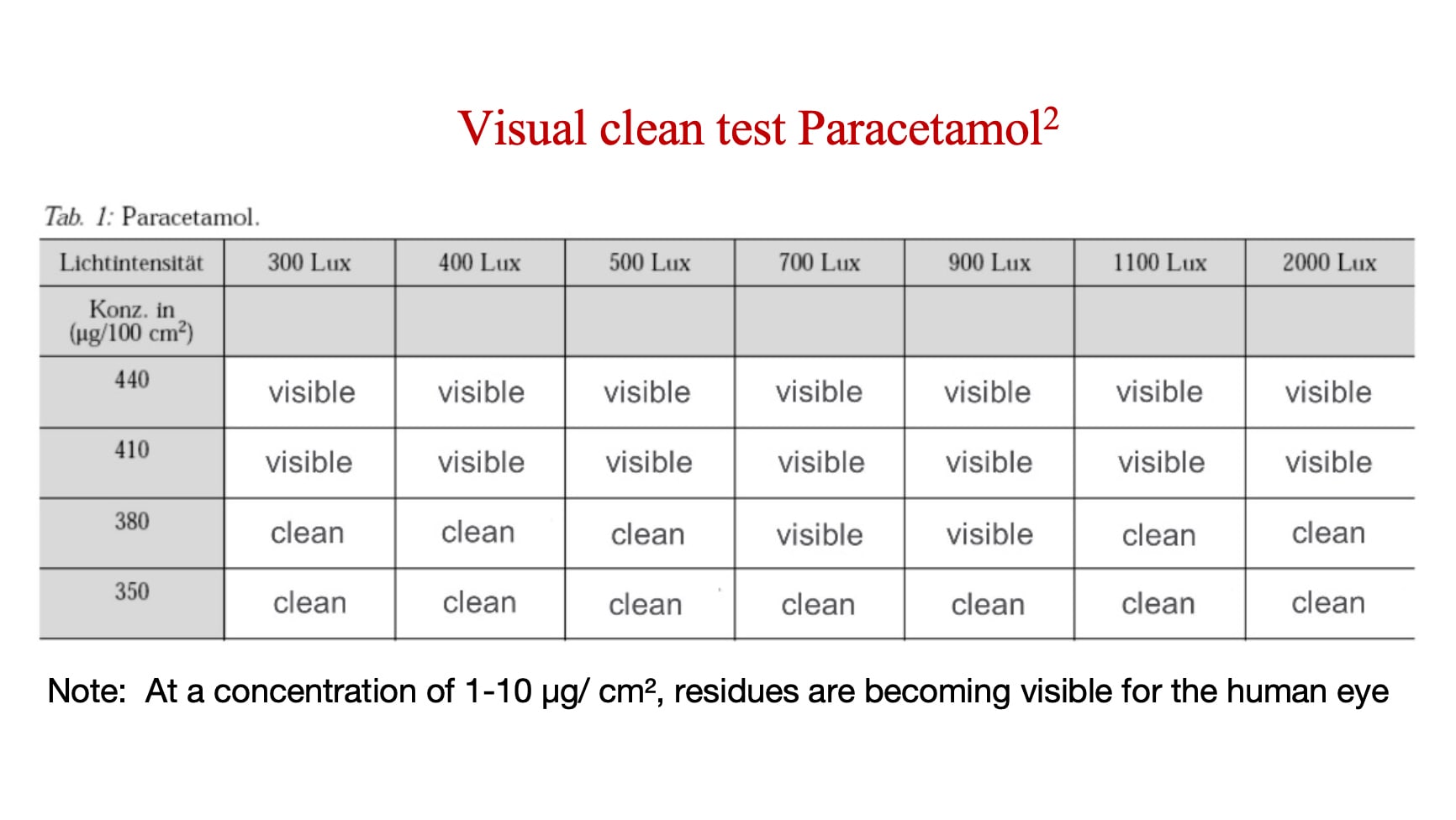
Com que frequência a visão de um inspetor precisa ser examinada?
Mais uma vez, as diretrizes não são específicas. Muitas empresas agora exigem que todos os operadores que realizam inspeções visuais façam um exame de vista todos os anos.
Isso não é exigido por lei. Por outro lado, se seus procedimentos de limpeza forem questionados, documentar que você forneceu treinamento completo para seus inspetores, depois testou a visão deles regularmente, será um grande passo para convencer as agências reguladoras de que você fez tudo o que poderia ser razoavelmente esperado.
Mais dúvidas?
Para obter mais informações sobre as melhores práticas e diretrizes de limpeza visual, entre em contato com a Life Sciences da Ecolab. Estamos presentes em locais da indústria farmacêutica no mundo todo e podemos fornecer percepções sobre como outros fabricantes implementam a limpeza visual em seus programas de validação da limpeza.
1FDA — CFR 21, parte 211.67, exigido no ponto (6) Inspeção de equipamento quanto à limpeza imediatamente antes do uso
2Pharm. Ind. 62, N.° 6 (2000) Buscalferri et al. — Reinigungsvalidierung


